Czy szczepionki na Covid są bezpieczne dla kobiet w ciąży
Pyrć: od dawna wiemy, że Szczepionki na Covid są bezpieczne i rekomendowane przez EMA dla kobiet w ciąży. A co na to Nauka?
"Panie Mariuszu - jak można Pana wesprzeć?" - zadał mi pytanie jeden z moich subskrybentów. Blog na Substacku jest to hobby czasochłonne, ale nie planowałem tej działalności, jako źródła dodatkowego dochodu (do tej pory mam jednego płatnego subskrybenta ochotnika). Ale jeśli ktokolwiek uważa, że warto udzielić mi wsparcie finansowe - to poniższa zrzutka daje taką możliwość. Za każdą wpłatę - serdecznie dziękuję :)
Pojawiają się komentarze, że szczepionki przeciw Covid-19 nie są zalecane u kobiet w ciąży. "To kłamstwo" – stwierdza wirusolog prof. Krzysztof Pyrć. - https://zdrowie.dziennik.pl/aktualnosci/artykuly/8494585,krzysztof-pyrc-covid-19-szczepionka-kobiety-w-ciazy-koronawirus.html
Specjalista przyznaje, że początkowo, kiedy wprowadzano szczepienia przeciwko Covid-19, nie było jeszcze pełnych danych. "Ale już od dawna wiemy, że są bezpieczne i są rekomendowane przez Europejską Agencję Leków (EMA)" – przekonuje na Twitterze prof. Krzysztof Pyrć z Małopolskiego Centrum Biotechnologii Uniwersytetu Jagiellońskiego w Krakowie.
To trudno wielu twiterowiczom sprawdzić bo Pyrć blokuje jak szalony – wystarczy się z nim nie zgodzić. Jak zaznacza, komentarze o tym, że szczepionki przeciw Covid-19 nie są zalecane u kobiet w ciąży, "to kłamstwo". O bezpieczeństwie szczepień przeciwko Covid-19 EMA pisze na swej stronie internetowej. Stwierdza, że produkt Corminaty (jedna ze szczepionek w technologii mRNA przeciwko Covid-19 - PAP) może być stosowana u kobiet w ciąży. Czy to jest równoznaczne z zaleceniem, skutecznością i bezpieczeństwem dla ciężarnych?
Ani autor artykułu ani Pan Pyrć nie podają żadnych linków do badań potwierdzających tezy o bezpieczeństwie stosowania szczepionek u ciężarnych – spróbujmy to zrobić za nich.
W tweecie użytkownik udostępnił odpowiedź Pfizera na pytanie m.in. dotyczące szczepień kobiet w ciąży: „Ten lek został warunkowo dopuszczony do obrotu. Oznacz to, że oczekuje się na więcej danych dotyczących leku. Europejska Agencja Leków dokona co najmniej raz w roku przeglądu nowych informacji o leku i w razie konieczności treść tej ulotki zostanie zaktualizowana”. (…) Informacje dotyczące wpływu na ciążę lub noworodka po zaszczepieniu w pierwszym trymestrze są obecnie ograniczone, jednak nie stwierdzono zmiany ryzyka poronienia”.
EMA dokonuje przeglądu i publikuje – cyklicznie uaktualniany – plik COMIRNATY (COVID-19 mRNA VACCINE) RISK MANAGEMENT PLAN – Plan zarządzania ryzykiem - https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf
Każdy kolejny dokument streszcza zmiany dokonane od poprzedniej publikacji. Opierając się na najnowszej wersji (tej z lutego 2022), sprawdźmy czy coś się zmieniło w kwestii szczepień kobiet ciężarnych oraz matek karmiących.
Na stronie 88 (Moduł SIV. Populacje niebadane w badaniach klinicznych) znajdziemy kryteria wyłączenia z badań klinicznych w ramach programu - wynika z nich, że z badań klinicznych wyłączone były:
- osoby szczepione jakąkolwiek szczepionką przeciwko koronawirusom
- osoby u których stwierdzono wcześniejsze kliniczne lub mikrobiologiczne rozpoznanie COVID-19 (ci uczestnicy mogą mieć pewien pewien stopień ochrony przed późniejszym zakażeniem SARS-CoV-2, co mogłoby zakłócać główny punkt końcowy skuteczności
- osoby z upośledzoną odpornością, ze znanym lub podejrzewanym niedoborem odporności (uczestnicy z upośledzoną odpornością mogą mieć osłabioną odpowiedź immunologiczną na szczepionki, co ograniczyłoby możliwość wykazania skuteczności, która jest pierwszorzędowym punktem końcowym)
- osoby, które przyjmowały produkty krwi/osocza lub immunoglobuliny w okresie 60 dni przed podaniem interwencji w ramach badania interwencyjnym lub planowanym przyjmowaniem w czasie trwania badania (Aby uniknąć zakłóceń w ocenie serologicznej lub klinicznej odpowiedzi immunologicznej w badanej populacji)
- kobiety w ciąży lub karmiące piersią (powód wykluczenia: aby uniknąć stosowania w populacji wrażliwe)j. Czy uważa się, że należy to uwzględnić jako brakujące informacje? Tak. Uzasadnienie: szczepienie matki szczepionką COVID 19 mRNA jest badane w C4591015 w celu zbadania nieoczekiwanych negatywnych skutków dla zarodka lub płodu) - poniżej zrzut ekranu tego wykluczenia
Czym jest badanie C4591015? Na stronie 40 dokumentu widnieje na liście interwencyjnych badań klinicznych szczepionki mRNA COVID-19 firmy Pfizer-BioNTech, które są w trakcie trwania.
C4591015 to “badanie fazy 2/3 kontrolowane placebo, randomizowane, z obserwowaną ślepą próbą, mające na celu ocenę bezpieczeństwa, tolerancji i immunogenności szczepionki SARS-CoV-2 RNA (BNT162b2) przeciwko COVID-19 u zdrowych kobiet w ciąży w wieku 18 lat i starszych. Łącznie 348 (209 w fazie 2 i 139 w fazie 3) kobiet w ciąży w czasie od 24 do 34 tygodni tygodni ciąży było randomizowanych w stosunku 1:1 do szczepionki lub placebo”. Badanie jest prowadzone przez Shanghai Fosun Pharmaceutical Development, Inc. i sponsorowane przez BioNTech. Planowany termin zakończenia badania - kwiecień 2023 r (termin przedstawienia końcowego raportu z badania - Clinical Study Report - CSR).
Szczegóły dotyczące badania C4591015 są na stronie 135 dokumentu: celem badania jest ocena bezpieczeństwa i immunogenność u kobiety w ciąży. Ponadto, cele eksploracyjne obejmują:
(a) Opisanie odpowiedzi immunologicznej u niemowląt urodzonych przez matki karmiącej piersią uczestniczek zaszczepionych profilaktyczną szczepionką COVID19 mRNA w czasie ciąży.
(b) Aby opisać bezpieczeństwo matczynego uodpornienia u niemowląt urodzonych przez matki karmiącej piersią zaszczepionych profilaktycznie szczepionką COVID-19 mRNA w czasie ciąży.
Na jakiej więc podstawie namawia się kobiety karmiące, które poddały się szczepieniu do karmienia dzieci piersią, twierdząc, że jest to bezpieczne, skoro odpowiedź na to pytanie ma przynieść badanie C4591015, które zakończy się w kwietniu 2023r.?
Strona 148, tabela 63 zawiera trwające i planowane badania dodatkowe w zakresie nadzoru nad bezpieczeństwem farmakoterapii:
Na stronie 164 dokumentu w tabeli 71, która przedstawia brakujące informacje dotyczące stosowanie szczepionki w ciąży i podczas karmienia piersią możemy zobaczyć, że jest więcej trwających badań, ale dotyczą one tylko kobiet w ciąży.
Na stronie 105 dokumentu w części dotyczącej zagrożeń uznanych za ważne do umieszczenia na Liście Zagrożeń dla Bezpieczeństwa w Planie Zarządzania Ryzykiem (RMP) jest napisane:
„Brak informacji: Stosowanie w ciąży i podczas karmienia piersią
Ocena ryzyka i korzyści:
Profil bezpieczeństwa szczepionki nie jest w pełni znany u kobiet w ciąży lub karmiących piersią ze względu na ich początkowe wykluczenie z kluczowego badania klinicznego, jednak dostępne są doświadczenia z okresu po wprowadzeniu szczepionki do obrotu u kobiet w ciąży. Dodatkowo trwa jedno badanie kliniczne bezpieczeństwa i immunogenności szczepionki COVID-19 u kobiet w ciąży (C4591015); zaplanowano 2 badania nieinterwencyjne (C4591009 i C4591011), aby ocenić, czy w interesujących subkohortach, takich jak kobiety w ciąży, występuje zwiększone ryzyko zdarzeń niepożądanych po otrzymaniu szczepionki COVID-19, a kolejne 2 badania nieinterwencyjne, C4591021 i C4591022, są w toku. Ważne jest, aby uzyskać długoterminową obserwację kobiet, które były w ciąży w czasie lub w okolicach szczepienia, tak aby można było ocenić wszelkie potencjalne negatywne konsekwencje dla ciąży i porównać je z wpływem szczepionki COVID-19 podawanej przez matkę na ciążę.”
Przytoczone w dokumencie trwające lub planowane badania kończą się odpowiednio (tabela 62):
C4591009 - 31 października 2025 (str. 131)
C4591011 - 31 grudnia 2023 (str. 131)
C4591021 - 30 września 2024 (str. 139)
C4591022 - 31 grudnia 2024 (str. 141)
Autorzy pisząc o wykluczeniu z badań klinicznych kobiet w ciąży i karmiących odwołują się do dostępnych doświadczeń z okresu po wprowadzeniu szczepionki do obrotu u kobiet w ciąży opublikowanych w badaniu: “Wstępne wyniki badań nad bezpieczeństwem szczepionki mRNA Covid-19 u kobiet w ciąży” https://www.nejm.org/doi/full/10.1056/nejmoa2104983
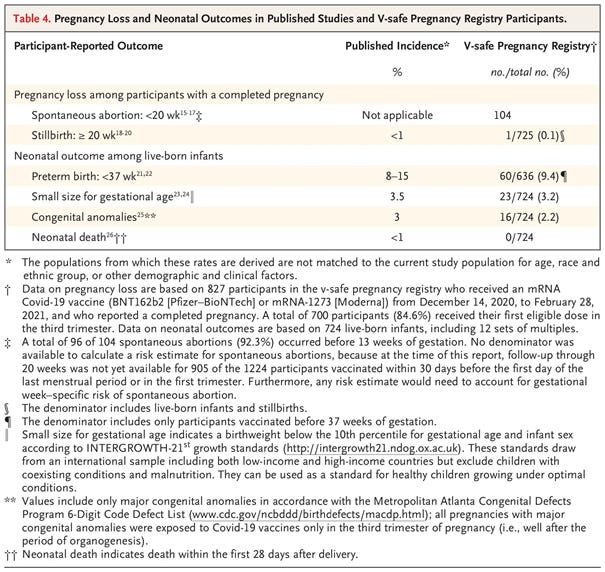
Wśród 827 uczestniczek, które ukończyły ciążę, 712 (86,1%) urodziło żywe dziecko, 104 (12,6%) spontanicznie poroniło, 1 (0,1%) dziecko urodziło się martwa, a 10 (1,2%) miało inne wyniki (aborcja indukowana i ciąża pozamaciczna). W sumie 96 ze 104 spontanicznych poronień (92,3%) wystąpiło przed 13 tygodniem ciąży, a 700 z 712 ciąż zakończonych żywym urodzeniem (98,3%) dotyczyło osób, które otrzymały pierwszą dawkę szczepionki w trzecim trymestrze ciąży. Niekorzystne wyniki wśród 724 żywo urodzonych niemowląt - w tym 12 dzieci z ciąży mnogiej - obejmowały przedwczesny poród (60 z 636 wśród zaszczepionych przed 37 tygodniem [9,4%]), mały rozmiar w stosunku do wieku ciążowego (23 z 724 [3,2%]) i poważne wady wrodzone (16 z 724 [2,2%]); w momencie przeprowadzania wywiadu nie zgłoszono żadnego zgonu noworodka.
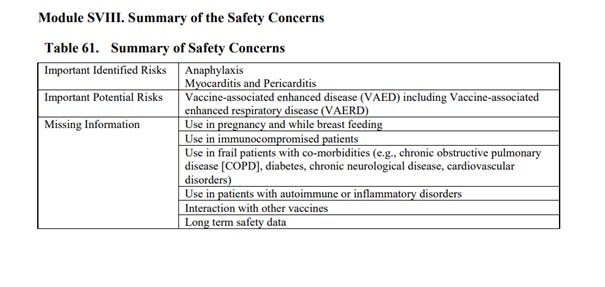
Podsumowując w dokumencie problemy związane z bezpieczeństwem szczepień na str. 119, w tabeli 61 widzimy, że producent zwraca uwagę na fakt, że nie ma informacji o bezpieczeństwie związanym ze stosowaniem preparatu u kobiet w ciąży i karmiących:
W tabeli 64 na str. 154 jest opis rutynowych środków minimalizacji ryzyka według zagrożeń dla bezpieczeństwa ale w części zalecającej konkretne środki kliniczne mające na celu eliminację ryzyka jest brak takowych:
Str. 154, tabela 66 podsumowująca działania w zakresie nadzoru nad bezpieczeństwem farmakoterapii i działania w zakresie minimalizacji ryzyka pokazuje zbiorczo trwające i planowane badania dotyczące kobiet w ciąży i karmiących - brak jest jakichkolwiek badań zakończonych - bo jak pamiętamy ta kohorta była wykluczona z badań klinicznych.
Niezwykle ciekawą lekturą jest inny dokument Pfizera pod nazwą “Badanie fazy 1/2/3 oceniające bezpieczeństwo, tolerancję, immunogenność i skuteczność szczepionek RNA przeciwko COVID-19 u zdrowych osób” opublikowane w listopadzie 2020: https://cdn.pfizer.com/pfizercom/2020-11/C4591001_Clinical_Protocol_Nov2020.pdf .
Na stronie 67 w części 8.3.5 Kontakt z uczestnikami badania w czasie ciąży lub karmienia piersią oraz narażenie w miejscu pracy czytamy, że Pfizer wymagał, żeby każdorazowo zgłaszać takie przypadki w przeciągu 24 godzin od zdarzenia.
Co to jest narażenie podczas ciąży (Exposure During Pregnancy - EPD)? Występuje wtedy, kiedy:
- stwierdzono, że uczestniczka jest w ciąży podczas trwania lub po przerwaniu uczestnictwo w badaniu
- stwierdzono, że kobieta jest w ciąży, gdy jest lub była narażona na oddziaływanie badania z powodu narażenia środowiskowego (czyli np. jeśli ktoś z rodziny lub pracownik medyczny zgłosi, że ciężarna mogła być narażona na kontakt z preparatem przez wdychanie lub kontakt przez dotyk, ale też wtedy, kiedy kobieta ma kontakt z kimś zaszczepionym w czasie lub tuż przed zapłodnieniem)
W takich przypadkach prowadzący badanie będzie śledził ciążę do jej zakończenia (lub do jej przerwania) i powiadamia firmę Pfizer Safety. Nieprawidłowe wyniki ciąży są uznawane za SAE (Serious Adverse Events - ciężkie NOPy). Jeśli wynik ciąży spełnia kryteria SAE (tj. ciąża pozamaciczna, poronienie samoistne, wewnątrzmaciczny zgon płodu, zgon noworodka lub wada wrodzona), badacz powinien postępować zgodnie z procedurami dla zgłaszania SAE. Punkt 8.3.5.2. dotyczy narażenia podczas karmienia piersią.
W tym dokumencie w punkcie 5.2 na str. 41-42 Pfizer szczegółowo podaje kryteria wykluczenia z badań klinicznych - pozycja 11 to kobiety w ciąży lub karmiące piersią.
Jakie podstawy naukowe mają te osoby, które twierdzą, że szczepienia na Covid-19 są bezpieczne dla kobiet w ciąży i karmiących?
W dalszej części dokumentu - w załączniku nr 4 podane są szczegółowe zalecenia antykoncepcyjne dla kandydatów do badań klinicznych - zarówno mężczyzn jak i kobiet. Do udziału w badaniu kwalifikują się mężczyźni, którzy w okresie badania i przez co najmniej 28 dni po przyjęciu ostatniej dawki, co odpowiada czasowi potrzebnemu do wyeliminowania ryzyka dla bezpieczeństwa reprodukcyjnego związanego z badaną interwencją (badanymi interwencjami), zgodzą się na spełnienie następujących wymagań: powstrzymają się od oddawania spermy i/albo zachowają abstynencję od stosunków heteroseksualnych z kobietą w wieku rozrodczym jako preferowanego i zwyczajowego stylu życia (abstynencja długotrwała i stała) oraz wyrażą zgodę na zachowanie abstynencji, lub zdecydują się na korzystanie z prezerwatyw podczas stosunku.
Wymagania dotyczące kobiet są bardziej szczegółowe i opisane na stronach 132 -135.
Ciekawe informacje można wyczytać w pozyskanych w ramach FOIA przez prawników ICAN materiałach wykorzystanych przez Szpital Dziecięcy w Cincinnati podczas prowadzenia badań nad dawką przypominającą firmy Pfizer, w tym u dzieci. Dokumenty przygotowane w porozumieniu z firmą Pfizer mówią nam wiele o tym, jak firma rozumie ryzyko związane ze swoimi produktami.
Firma Pfizer wydaje się być bardzo zaniepokojona potencjalną teratogenezą (szkodliwym działaniem na rozwijający się płód), a nawet mutagenezą (szkodliwym działaniem na DNA). Dlatego, mimo że są to badania na dzieciach, firma Pfizer poinformowała rodziców tych dzieci, że "wpływ szczepionki COVID-19 na spermę, ciążę, płód lub dziecko karmione piersią nie jest znany".
Ale potem Pfizer idzie jeszcze dalej i stwierdza, że:
- jeśli Twoja córka jest w ciąży, planuje zajść w ciążę lub karmi dziecko piersią, nie może brać udziału w badaniu, ponieważ może to stanowić ryzyko dla nienarodzonego dziecka lub dziecka karmionego piersią
- jeśli Pani córka zajdzie w ciążę, będzie musiała opuścić badanie
- jeśli Twoje dziecko jest chłopcem i sądzi, że mogło zajść w ciążę z dziewczynką, musisz natychmiast poinformować o tym lekarza prowadzącego badanie Twojego dziecka. Lekarz prowadzący badanie może poprosić o informacje na temat ciąży i narodzin dziecka. Lekarz prowadzący badanie może podzielić się tymi informacjami z innymi osobami pracującymi przy tym badaniu
- jeśli Twój syn bierze udział w tym badaniu, nie może oddawać nasienia przez co najmniej 28 dni po ostatnim szczepieniu
Biorąc powyższe pod uwagę, zalecenie CDC aby kobiety w ciąży poddały się szczepieniu, jest co najmniej nieuzasadnione naukowo.
Skoro producent (BioNTech/Pfizer) ostrzega: "Dostępne dane dotyczące szczepionki COMIRNATY podawanej kobietom w ciąży są niewystarczające, aby poinformować o ryzyku związanym ze szczepieniem kobiet w ciąży", to na jakiej podstawie rząd prowadzi rozległą kampanię reklamowa, w której twierdzi się, że szczepienia są bezpieczne dla kobiet w ciąży a na stronie rządowej możemy przeczytać: "Wyniki dostępnych badań potwierdzają, że szczepionki przeciw COVID-19 są bezpieczne dla kobiet w okresie ciąży. Dlatego Centrum Kontroli i Zapobiegania Chorób (CDC) zaleca, aby kobiety w ciąży zaszczepiły się przeciw COVID-19 ze względu na bezpieczeństwo swoje i rozwijającego się płodu." https://www.gov.pl/web/edukacja-i-nauka/wybierz-madrze-zaszczep-sie--kampania-informacyjna-dotyczaca-szczepien ???
W informacji Prezesa Urzędu z dnia 18.01.2022 r. na temat najnowszych danych dotyczących bezpieczeństwa stosowania szczepionek mRNA w czasie ciąży - https://urpl.gov.pl/pl/informacja-prezesa-urz%C4%99du-z-dnia-18012022-r-na-temat-najnowszych-danych-dotycz%C4%85cych-bezpiecze%C5%84stwa czytamy: „Wstępne badania kliniczne na ogół nie obejmują kobiet w ciąży. W rezultacie dane dotyczące stosowania szczepionek, podobnie jak innych leków w okresie ciąży, zwykle nie są dostępne w momencie wydania pozwolenia, ale uzyskuje się je później. Badania na zwierzętach ze szczepionkami COVID-19 nie wykazały żadnych szkodliwych skutków dla ciąży lub rozwoju pourodzeniowego. Przegląd danych zebranych z warunkach rzeczywistego stosowania (Real World Data) sugeruje, że korzyści płynące ze szczepionek mRNA przeciw COVID-19 podczas ciąży przewyższają wszelkie możliwe ryzyko dla przyszłych matek i nienarodzonych dzieci.” Jakimi badaniami dysponujemy?
FDA i CDC, EMA – a w Polsce URPLWMiPB - mają do wykonania zadanie - ocenić dowody bez uprzedzeń, aby zapewnić społeczeństwu bezpieczeństwo. Zamiast tego instytucje te zamieniły się w dział marketingu działający na rzecz przemysłu farmaceutycznego.
Czytając powyższe dokumenty wypada zadać pytanie, na jakiej podstawie producent szczepionki podaje w ulotce na stronach 88, 100 i 110 (dostępna tu https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_pl.pdf ): “Ciąża i karmienie piersią - Jeśli pacjentka jest w ciąży, należy powiedzieć o tym lekarzowi, pielęgniarce lub farmaceucie przed otrzymaniem tej szczepionki. Szczepionka Comirnaty może być stosowana w okresie ciąży. Informacje uzyskane od dużej liczby kobiet zaszczepionych w drugim i trzecim trymestrze ciąży szczepionką Comirnaty nie wykazały niekorzystnego wpływu na ciążę lub noworodka. Informacje dotyczące wpływu na ciążę lub noworodka po zaszczepieniu w pierwszym trymestrze są obecnie ograniczone, jednakże nie stwierdzono zmiany ryzyka poronienia. Szczepionka Comirnaty może być podawana podczas karmienia piersią”.
Serio?
Źródła:
https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf
https://cdn.pfizer.com/pfizercom/2020-11/C4591001_Clinical_Protocol_Nov2020.pdf
https://www.icandecide.org/wp-content/uploads/2022/02/Substudy-B-Informed-Consent-Form-002.pdf
Więcej o badaniach w szpitalu w Cincinnati: