Szczepienia mRNA bezpieczne dla kobiet w ciąży? Tak twierdzi prof. Szuster-Ciesielska...
Co naprawdę mówi o tym Pfizer i EMA - weryfikacja dostępnych informacji
"Panie Mariuszu - jak można Pana wesprzeć?" - zadał mi pytanie jeden z moich subskrybentów. Blog na Substacku jest to hobby czasochłonne, ale nie planowałem tej działalności, jako źródła dodatkowego dochodu (do tej pory mam jednego płatnego subskrybenta ochotnika). Ale jeśli ktokolwiek uważa, że warto udzielić mi wsparcie finansowe - to poniższa zrzutka daje taką możliwość. Za każdą wpłatę - serdecznie dziękuję :)
Agnieszka Szuster-Ciesielska przekonuje w tweecie, że „najnowsze dane dają pewność bezpieczeństwa szczepionek mRNA w czasie ciąży”, wtóruje jej rządowa agencja marketingowa @szczepimysie pisząc, że „Szczepionki przeciwko COVID-19 nie powodują powikłań ciążowych u przyszłych matek i ich dzieci” – oba tweety powołują się na artykuł umieszczony na stronach EMA pod linkiem https://www.ema.europa.eu/en/news/covid-19-latest-safety-data-provide-reassurance-about-use-mrna-vaccines-during-pregnancy




Przyjrzyjmy się artykułowi oraz innym dowodom udostępnionym przez firmę Pfizer.
W artykule zatytułowanym „COVID-19: najnowsze dane dotyczące bezpieczeństwa dają pewność co do stosowania szczepionek mRNA w czasie ciąży” czytamy:
„Szczepienia pozostają głównym filarem reakcji na wirus COVID-19, zwłaszcza że warianty tego wirusa nadal rozprzestrzeniają się w krajach UE. Grupa zadaniowa EMA ds. COVID-19 (ETF) podkreśla rosnącą liczbę dowodów wskazujących na to, że szczepionki mRNA przeciwko COVID-19 nie powodują powikłań w czasie ciąży u przyszłych matek i ich dzieci.
Grupa ta dokonała szczegółowego przeglądu kilku badań obejmujących około 65 000 ciąż na różnych etapach. W wyniku przeglądu nie stwierdzono żadnych oznak zwiększonego ryzyka powikłań ciąży, poronień, przedwczesnych porodów lub działań niepożądanych u nienarodzonych dzieci po szczepieniu szczepionką mRNA COVID-19. Pomimo pewnych ograniczeń w danych, wyniki wydają się być spójne we wszystkich badaniach dotyczących tych efektów.” à jakich? Nie wiadomo…
Badania wykazały również, że szczepionki COVID-19 są tak samo skuteczne w zmniejszaniu ryzyka hospitalizacji i zgonów u osób w ciąży, jak u osób niebędących w ciąży. Najczęstsze działania niepożądane szczepionek u osób w ciąży również pokrywają się z tymi występującymi w całej zaszczepionej populacji. Obejmują one ból w miejscu wstrzyknięcia, zmęczenie, ból głowy, zaczerwienienie i obrzęk w miejscu wstrzyknięcia, ból mięśni i dreszcze. Działania te są zwykle łagodne lub umiarkowane i ustępują w ciągu kilku dni po szczepieniu.
Biorąc pod uwagę, że do tej pory ciąża była związana z większym ryzykiem wystąpienia ciężkiej postaci COVID-19, szczególnie w drugim i trzecim trymestrze ciąży, osoby, które są w ciąży lub mogą zajść w ciążę w najbliższej przyszłości są zachęcane do zaszczepienia się zgodnie z krajowymi zaleceniami.
Większość zgromadzonych informacji dotyczy szczepionek mRNA (Comirnaty i Spikevax). EMA dokona również przeglądu danych dotyczących innych dopuszczonych do obrotu szczepionek COVID-19, gdy staną się one dostępne. (przyp. czyli nie wiemy czy są bezpieczne?)
We wstępnych badaniach klinicznych z reguły nie uczestniczą osoby w ciąży. W związku z tym dane dotyczące stosowania szczepionek, podobnie jak innych leków, w okresie ciąży nie są zazwyczaj dostępne w momencie wydawania pozwolenia na dopuszczenie do obrotu, lecz są uzyskiwane po tym fakcie. Badania na zwierzętach z zastosowaniem szczepionek COVID-19 nie wykazały szkodliwego działania w okresie ciąży lub rozwoju pourodzeniowego. Przegląd rzeczywistych dowodów sugeruje, że korzyści z otrzymywania szczepionek mRNA COVID-19 w czasie ciąży przewyższają wszelkie możliwe zagrożenia dla przyszłych matek i nienarodzonych dzieci.
Komitet ds. Leków Stosowanych u Ludzi EMA (CHMP) rozważy najnowsze dane uzyskane od producentów szczepionek mRNA COVID-19 w okresie ciąży w celu aktualizacji zaleceń zawartych w informacjach o produkcie dla tych szczepionek, w stosownych przypadkach.
Zgodnie z unijnym planem monitorowania bezpieczeństwa szczepionek COVID-19, szczepionki te są ściśle monitorowane, a pojawiające się istotne nowe informacje są stale gromadzone i niezwłocznie analizowane. Chociaż bardzo duża liczba osób otrzymała już szczepionki COVID-19, w miarę włączania coraz większej liczby osób do programów szczepień nadal mogą pojawiać się pewne działania niepożądane. Komitet ds. bezpieczeństwa EMA, PRAC, będzie nadal monitorował bezpieczeństwo stosowania szczepionki w okresie ciąży.
Firmy są zobowiązane do dostarczania regularnych aktualizacji i prowadzenia badań w celu monitorowania bezpieczeństwa i skuteczności ich szczepionek stosowanych przez społeczeństwo. Władze przeprowadzają również dodatkowe badania w celu monitorowania bezpieczeństwa i skuteczności szczepionek, w tym ich stosowania w okresie ciąży. (przyp. jakie badania prowadzone są w Polsce??)
Środki te umożliwiają organom regulacyjnym szybką ocenę danych pochodzących z wielu różnych źródeł i w razie potrzeby podjęcie odpowiednich działań regulacyjnych w celu ochrony zdrowia publicznego.”
EMA podaje źródła na których opiera swoje przekonanie. Jednym z nich jest badanie opublikowane w JAMA (https://jamanetwork.com/journals/jama/fullarticle/2784193 ) zatytułowane „Spontaniczna aborcja po szczepieniu COVID-19 w czasie ciąży” w którym ujawniony konflikt interesów dotyczy 3 z 7 autorów: Dr Lipkind poinformował, że jest członkiem niezależnego zewnętrznego komitetu monitorującego dane dotyczące szczepionki COVID-19 firmy Pfizer; Dr Naleway poinformował o otrzymaniu funduszy na badania od firmy Pfizer na potrzeby niepowiązanego badania; Dr Vesco zgłosił otrzymywanie funduszy na badania od firmy Pfizer na potrzeby niepowiązanego badania. We wstępie zaś czytamy: „Dotychczasowe dane dotyczące bezpieczeństwa szczepionki COVID-19 pochodzą głównie z biernego nadzoru, a w badaniach brakuje nieszczepionej grupy porównawczej.”
Innym przywołanym przez EMA badaniem jest „Wstępne wyniki badań nad bezpieczeństwem szczepionki mRNA Covid-19 u kobiet w ciąży” https://www.nejm.org/doi/full/10.1056/nejmoa2104983 które spotkało się z krytyką w recenzowanym badaniu, ze względu błędy analizie danych: „Nasza ponowna analiza wskazuje na skumulowaną częstość występowania spontanicznej aborcji 7 do 8 razy wyższą niż wyniki oryginalnych autorów. Recenzowane badanie wezwało do "natychmiastowego wycofania szczepionek mRNA COVID dla kobiet w ciąży, karmiących piersią, w wieku rozrodczym i dzieci po tym, jak ich szokujące badanie ujawniło oszałamiające wyniki ciężarnych zaszczepionych mRNA: 92% kobiet miało spontaniczne poronienie w ciągu pierwszych 13 tygodni...podczas gdy 81. 9% kobiet, które otrzymały szczepionkę mRNA COVID, poroniło samoistnie w ciągu pierwszych 20 tygodni. „Biorąc pod uwagę przedstawione tu dowody, sugerujemy natychmiastowe wycofanie stosowania szczepionek mRNA u kobiet w ciąży i karmiących piersią, a także wycofanie szczepionek mRNA u dzieci lub osób w wieku rozrodczym w populacji ogólnej, do czasu uzyskania bardziej przekonujących danych dotyczących bezpieczeństwa i długoterminowego wpływu na płodność, ciążę i reprodukcję w tych grupach.” Całość tu: https://cf5e727d-d02d-4d71-89ff-9fe2d3ad957f.filesusr.com/ugd/adf864_2bd97450072f4364a65e5cf1d7384dd4.pdf
EMA podaje także w artykule link do strony dedykowanej szczepionce Comirnaty – gdzie w części ogólnej czytamy: “Badania na zwierzętach nie wykazują szkodliwego działania w okresie ciąży, jednak dane dotyczące stosowania produktu Comirnaty w okresie ciąży są ograniczone. Pomimo braku badań dotyczących karmienia piersią, nie przewiduje się ryzyka związanego z karmieniem piersią. Decyzja o zastosowaniu szczepionki u kobiet w ciąży powinna być podjęta w ścisłej konsultacji z pracownikiem służby zdrowia po rozważeniu korzyści i ryzyka.”
Możemy także zapoznać się z dokumentami (EPAR - European public assessment report) dostarczanymi przez Pfizer: “COMIRNATY (COVID-19 mRNA VACCINE) PLAN ZARZĄDZANIA RYZYKIEM” https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf.
W części dotyczącej „Stosowania w ciąży i podczas karmienia piersią” czytamy:
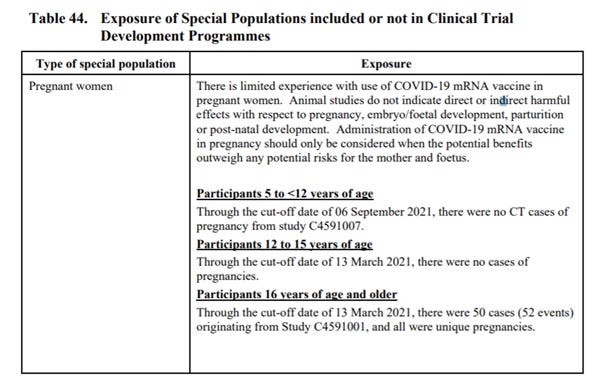
„Profil bezpieczeństwa szczepionki nie jest znany u kobiet w ciąży i karmiących piersią ze względu na ich początkowe wykluczenie z kluczowego badania klinicznego. Kobiety w ciąży, które zdecydują się na szczepienie pomimo braku danych dotyczących bezpieczeństwa - ważne będzie obserwowanie tych kobiet pod kątem przebiegu ciąży i porodu. Moment szczepienia kobiety ciężarnej i następująca po nim odpowiedź immunologiczna mogą mieć różny, korzystny lub niekorzystny wpływ na zarodek/płód. Kliniczne konsekwencje zakażenia SARS-CoV-2 dla kobiety i płodu w czasie ciąży nie są jeszcze w pełni poznane, a wyjściowy stan zdrowia kobiety ciężarnej może mieć wpływ zarówno na przebieg kliniczny jej ciąży, jak i na nasilenie COVID-19. Czynniki te oraz stopień, w jakim kobieta ciężarna może być narażona na ekspozycję na SARS-CoV-2, będą miały wpływ na rozważania dotyczące korzyści i ryzyka związanego ze stosowaniem szczepionki. Brak danych jest komunikowany w etykietach produktów.
Pfizer ostrzega, że “Istnieją ograniczone doświadczenia dotyczące stosowania szczepionki COVID-19 mRNA u kobiet w ciąży. Badania na zwierzętach nie wskazują na bezpośrednie lub pośrednie szkodliwe działanie w odniesieniu do ciąży, rozwoju zarodka/płodu, porodu lub rozwoju pourodzeniowego. Podawanie szczepionki COVID-19 mRNA w ciąży należy rozważać jedynie w przypadku, gdy potencjalne korzyści przewyższają potencjalne ryzyko dla matki i płodu.”
Wpływ na ryzyko i korzyści - profil bezpieczeństwa szczepionki nie jest znany u kobiet w ciąży lub karmiących piersią ze względu na ich początkowe wykluczenie z kluczowego badania klinicznego, jednak trwa jedno badanie kliniczne bezpieczeństwa i immunogenności szczepionki COVID-19 u kobiet w ciąży (C4591015); zatwierdzono również 2 badania nieinterwencyjne (C4591009 i C4591011) oceniające, czy w interesujących subkohortach, takich jak kobiety w ciąży, występuje zwiększone ryzyko zdarzeń niepożądanych po otrzymaniu szczepionki COVID-19. Ważne jest uzyskanie długoterminowej obserwacji kobiet, które były w ciąży w czasie lub w okolicy czasu szczepienia, aby można było ocenić wszelkie potencjalne negatywne skutki dla ciąży i porównać je z wpływem szczepionki COVID-19 podawanej przez matkę na ciążę. Wspomniane badania trwają i kończą się w 2022, 2023, 2024 i 2025r.
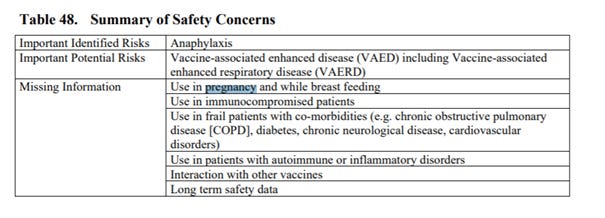
Pfizer podaje listę istotnych ryzyk związanych ze szczepionką - jest to ryzyko związane z produktem leczniczym Comirnaty, które wymaga specjalnych działań w zakresie zarządzania ryzykiem w celu jego dalszego zbadania lub zminimalizowania, tak aby produkt leczniczy mógł być bezpiecznie podawany. Istotne ryzyko może być uznane za zidentyfikowane lub potencjalne. Ryzyko zidentyfikowane to ryzyko, dla którego istnieją wystarczające dowody na związek ze stosowaniem produktu Comirnaty.
Ryzyko potencjalne to ryzyko, którego związek ze stosowaniem tego leku jest możliwy na podstawie dostępnych danych, ale związek ten nie został jeszcze ustalony i wymaga dalszej oceny. Brakujące informacje odnoszą się do informacji dotyczących bezpieczeństwa stosowania produktu leczniczego, których obecnie brakuje i które należy zebrać (np. dotyczące długotrwałego stosowania leku).
Jak wobec tych danych można odpowiedzialnie powiedzieć, że "mamy pewność co do bezpieczeństwa stosowania szczepionek mRNA w czasie ciąży"????
Uzupełnienie
Przeglądając dokument w maju 2022 (chodzi o “COMIRNATY (COVID-19 mRNA VACCINE) PLAN ZARZĄDZANIA RYZYKIEM” https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf zauważyłem różnice w numeracji tabel - wygląda na to, że pod tym samym linkiem znajduje się najnowsza wersja dokumentu.
W archiwum Internetu (WebArchive.org) można znaleźć wersje poprzednie - pod tym linkiem widać, ze zmiany były dosyć częste: https://web.archive.org/web/collections/20210301000000*/http://https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf
Poniżej linki do wersji z:
29 kwietnia 2021: https://web.archive.org/web/20210626041553/http://https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf
24 września 2021: https://web.archive.org/web/20211123214619/http://https://www.ema.europa.eu/en/documents/rmp-summary/comirnaty-epar-risk-management-plan_en.pdf
Każdy kolejny dokument streszcza zmiany dokonane od poprzedniej publikacji. Opierając się na najnowszej wersji (tej z lutego 2022), sprawdźmy czy coś się zmieniło w kwestii szczepień kobiet ciężarnych oraz matek karmiących.
Na stronie 88 (Moduł SIV. Populacje niebadane w badaniach klinicznych) znajdziemy kryteria wyłączenia z badań klinicznych w ramach programu - wynika z nich, że z badań klinicznych wyłączeni były:
osoby szczepione jakąkolwiek szczepionką przeciwko koronawirusom
osoby u których stwierdzono wcześniejsze kliniczne lub mikrobiologiczne rozpoznanie COVID-19 (ci uczestnicy mogą mieć pewien pewien stopień ochrony przed późniejszym zakażeniem SARS-CoV-2, co mogłoby
zakłócać główny punkt końcowy skuteczności
Osoby z upośledzoną odpornością, ze znanym lub podejrzewanym niedoborem odporności (uczestnicy z upośledzoną odpornością mogą mieć osłabioną odpowiedź immunologiczną na szczepionki, co ograniczyłoby możliwość wykazania skuteczności, która jest pierwszorzędowym punktem końcowym)
osoby, które przyjmowały produkty krwi/osocza lub immunoglobuliny w okresie 60 dni przed podaniem interwencji w ramach badania interwencyjnym lub planowanym przyjmowaniem w czasie trwania badania (Aby uniknąć zakłóceń w ocenie serologicznej lub klinicznej odpowiedzi immunologicznej w badanej populacji)
kobiety w ciąży lub karmiące piersią (powód wykluczenia: aby uniknąć stosowania w populacji wrażliwej. Czy uważa się, że należy to uwzględnić jako brakujące informacje? Tak. Uzasadnienie: szczepienie matki szczepionką COVID 19 mRNA jest badane w C4591015 w celu zbadania nieoczekiwanych negatywnych skutków dla zarodka lub płodu) - poniżej zrzut ekranu tego wykluczenia
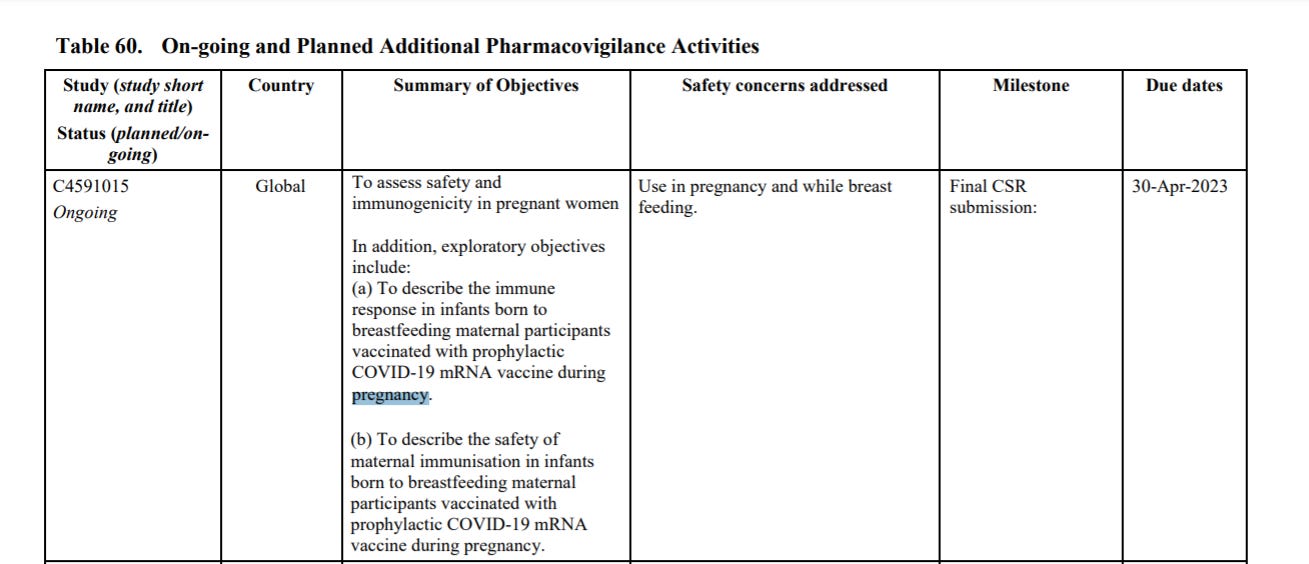
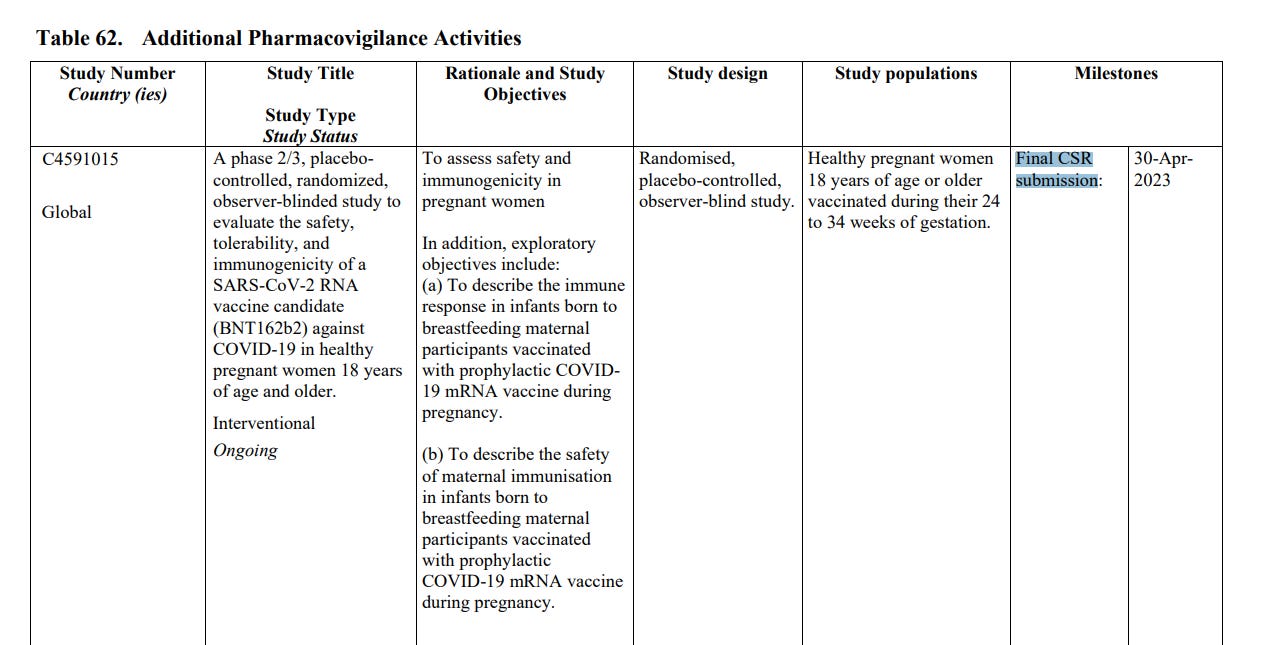
Czym jest badanie C4591015? Na stronie 40 dokumentu widnieje na liście interwencyjnych badań klinicznych szczepionki mRNA COVID-19 firmy Pfizer-BioNTech, które są w trakcie trwania.
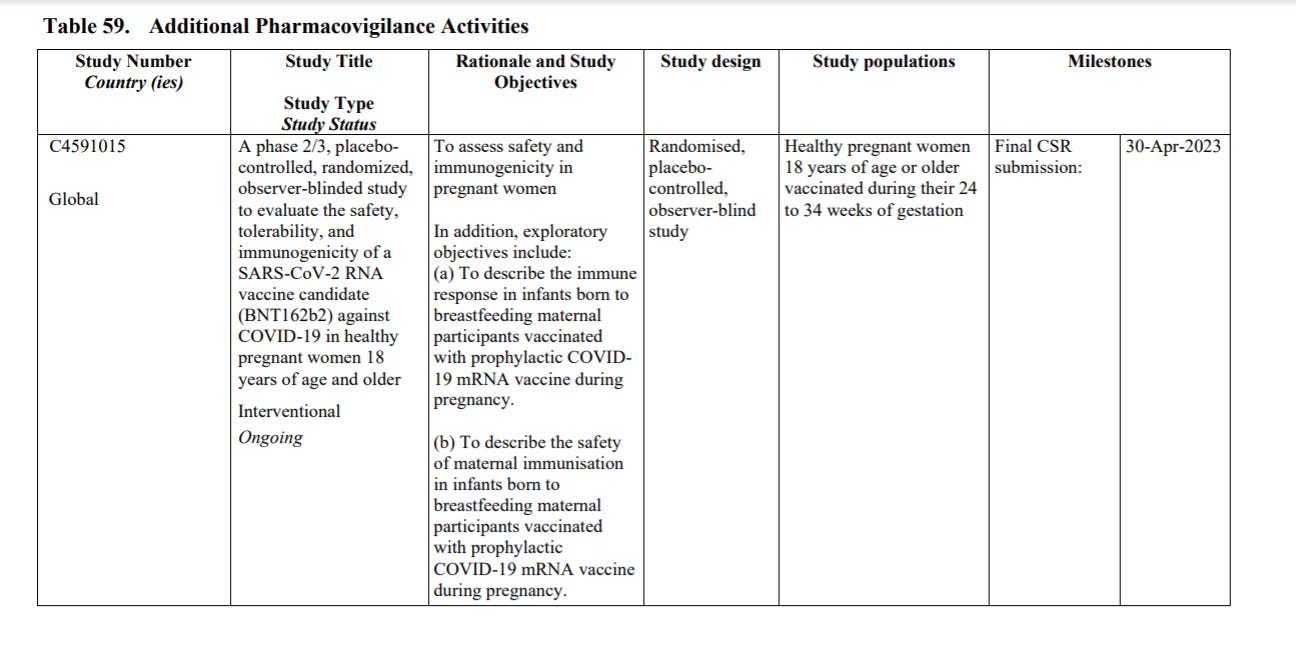
C4591015 to “badanie fazy 2/3 kontrolowane placebo, randomizowane, z obserwowaną ślepą próbą, mające na celu ocenę bezpieczeństwa, tolerancji i immunogenności szczepionki SARS-CoV-2 RNA (BNT162b2) przeciwko COVID-19 u zdrowych kobiet w ciąży w wieku 18 lat i starszych. Łącznie 348 (209 w fazie 2 i 139 w fazie 3) kobiet w ciąży w czasie od 24 do 34 tygodni tygodni ciąży było randomizowanych w stosunku 1:1 do szczepionki lub placebo”. Badanie jest prowadzone przez Shanghai Fosun Pharmaceutical Development, Inc. i sponsorowane przez BioNTech. Planowany termin zakończenia badania - kwiecień 2023 r (termin przedstawienia końcowego raportu z badania - Clinical Study Report - CSR).
Szczegóły dotyczące badania C4591015 są na stronie 135 dokumentu: celem badania jest ocena bezpieczeństwa i immunogenność u kobiety w ciąży. Ponadto, cele eksploracyjne eksploracyjne obejmują:
(a) Opisanie odpowiedzi immunologicznej u niemowląt urodzonych przez matki karmiącej piersią uczestniczek zaszczepionych profilaktyczną szczepionką COVID19 mRNA w czasie ciąży.
(b) Aby opisać bezpieczeństwo matczynego uodpornienia u niemowląt urodzonych przez matki karmiącej piersią zaszczepionych profilaktycznie szczepionką COVID-19 mRNA w czasie ciąży.
Na jakiej więc podstawie namawia się kobiety karmiące, które poddały się szczepieniu do karmienia dzieci piersią, twierdząc, że jest to bezpieczne, skoro odpowiedź na to pytanie ma przynieść badanie C4591015, które zakończy się w kwietniu 2023r.?
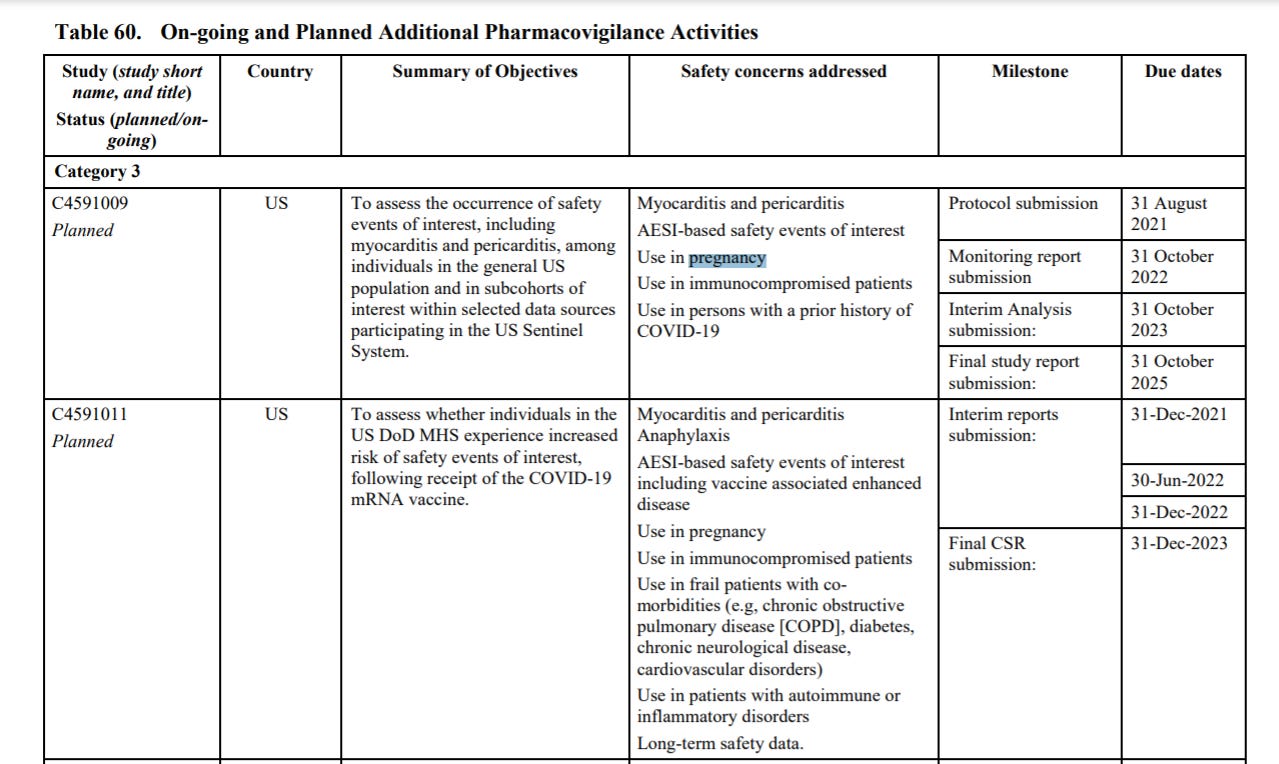
Strona 148, tabela 63 zawiera trwające i planowane badania dodatkowe w zakresie nadzoru nad bezpieczeństwem farmakoterapii:
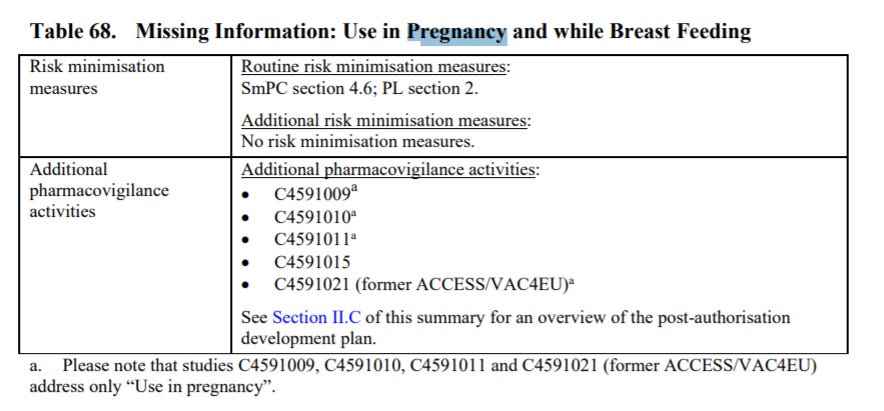
Na stronie 164 dokumentu w tabeli 71, która przedstawia brakujące informacje dotyczące stosowanie szczepionki w ciąży i podczas karmienia piersią możemy zobaczyć, że jest więcej trwających badań, ale dotyczą one tylko kobiet w ciąży.
Na stronie 105 dokumentu w części dotyczącej zagrożeń uznanych za ważne do umieszczenia na Liście Zagrożeń dla Bezpieczeństwa w Planie Zarządzania Ryzykiem (RMP) jest napisane:
Brak informacji: Stosowanie w ciąży i podczas karmienia piersią
Ocena ryzyka i korzyści:
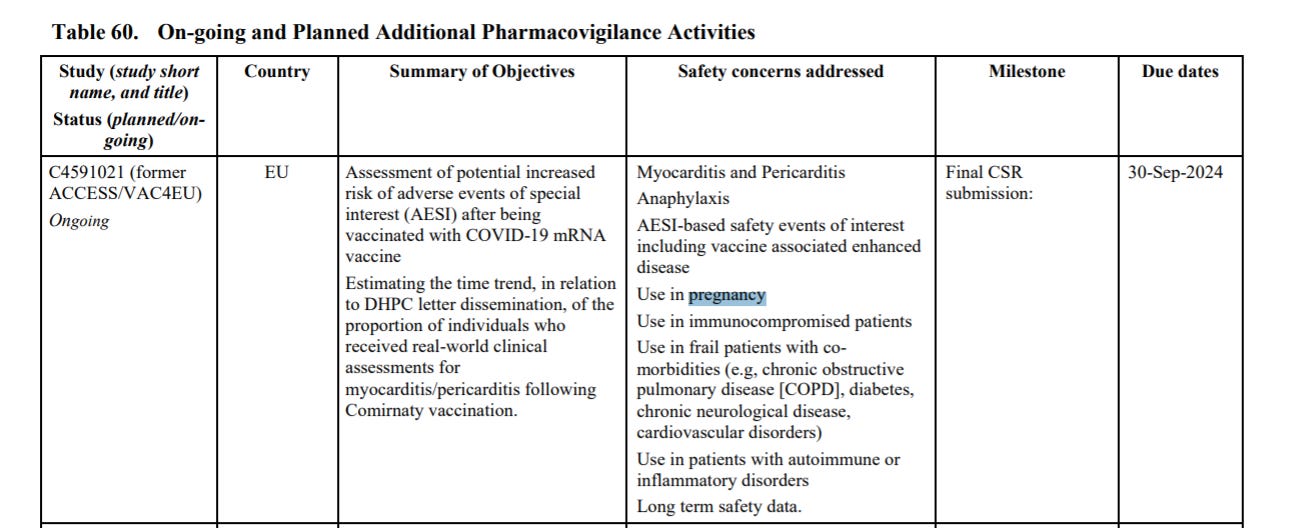
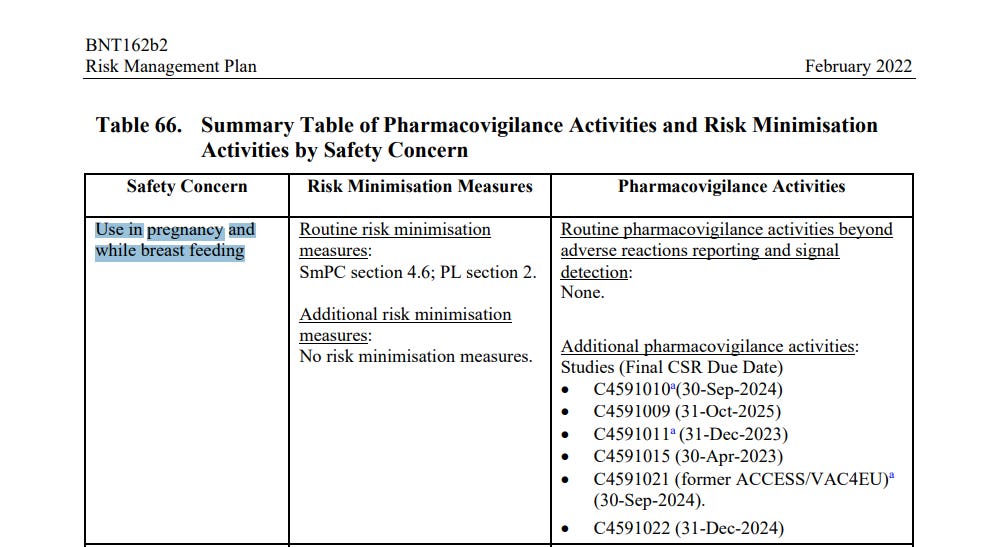
Profil bezpieczeństwa szczepionki nie jest w pełni znany u kobiet w ciąży lub karmiących piersią ze względu na ich początkowe wykluczenie z kluczowego badania klinicznego, jednak dostępne są doświadczenia z okresu po wprowadzeniu szczepionki do obrotu u kobiet w ciąży. Dodatkowo trwa jedno badanie kliniczne bezpieczeństwa i immunogenności szczepionki COVID-19 u kobiet w ciąży (C4591015); zaplanowano 2 badania nieinterwencyjne (C4591009 i C4591011), aby ocenić, czy w interesujących subkohortach, takich jak kobiety w ciąży, występuje zwiększone ryzyko zdarzeń niepożądanych po otrzymaniu szczepionki COVID-19, a kolejne 2 badania nieinterwencyjne, C4591021 i C4591022, są w toku. Ważne jest, aby uzyskać długoterminową obserwację kobiet, które były w ciąży w czasie lub w okolicach szczepienia, tak aby można było ocenić wszelkie potencjalne negatywne konsekwencje dla ciąży i porównać je z wpływem szczepionki COVID-19 podawanej przez matkę na ciążę.
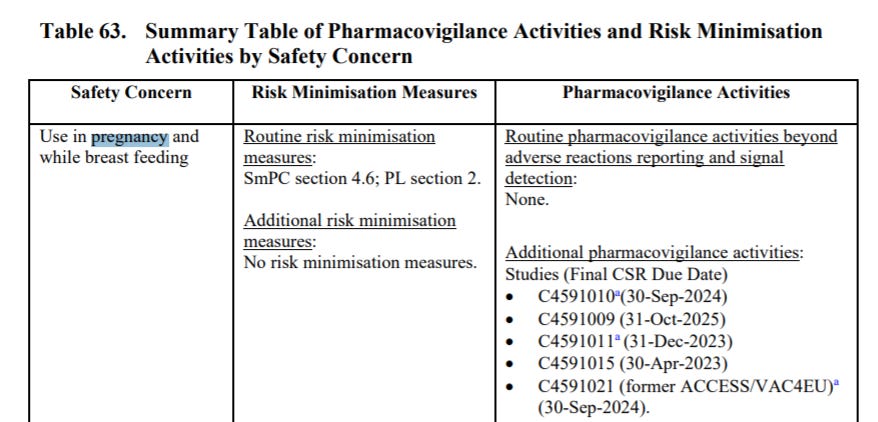
Przytoczone w dokumencie trwające lub planowane badania kończą się odpowiednio (tabela 62):
C4591009 - 31 października 2025 (str. 131)
C4591011 - 31 grudnia 2023 (str. 131)
C4591021 - 30 września 2024 (str. 139)
C4591022 - 31 grudnia 2024 (str. 141)
Autorzy pisząc o wykluczeniu z badań klinicznych kobiet w ciąży i karmiących odwołują się do dostępnych doświadczeń z okresu po wprowadzeniu szczepionki do obrotu u kobiet w ciąży opublikowanych w badaniu: “Wstępne wyniki badań nad bezpieczeństwem szczepionki mRNA Covid-19 u kobiet w ciąży” https://www.nejm.org/doi/full/10.1056/nejmoa2104983
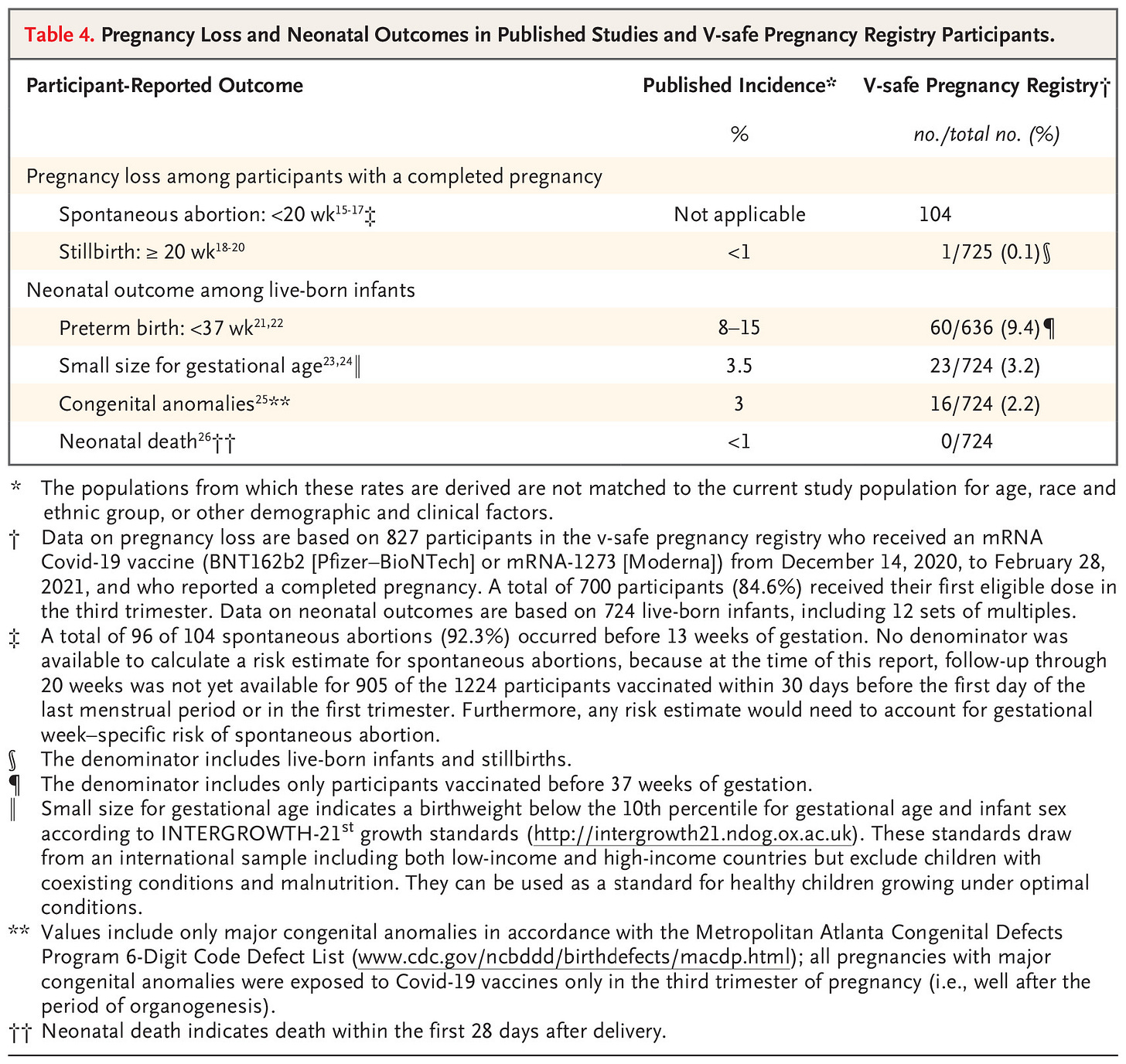
Wśród 827 uczestniczek, które ukończyły ciążę, 712 (86,1%) urodziło żywe dziecko, 104 (12,6%) spontanicznie poroniło, 1 (0,1%) dziecko urodziło się martwa, a 10 (1,2%) miało inne wyniki (aborcja indukowana i ciąża pozamaciczna). W sumie 96 ze 104 spontanicznych poronień (92,3%) wystąpiło przed 13 tygodniem ciąży, a 700 z 712 ciąż zakończonych żywym urodzeniem (98,3%) dotyczyło osób, które otrzymały pierwszą dawkę szczepionki w trzecim trymestrze ciąży. Niekorzystne wyniki wśród 724 żywo urodzonych niemowląt - w tym 12 dzieci z ciąży mnogiej - obejmowały przedwczesny poród (60 z 636 wśród zaszczepionych przed 37 tygodniem [9,4%]), mały rozmiar w stosunku do wieku ciążowego (23 z 724 [3,2%]) i poważne wady wrodzone (16 z 724 [2,2%]); w momencie przeprowadzania wywiadu nie zgłoszono żadnego zgonu noworodka.
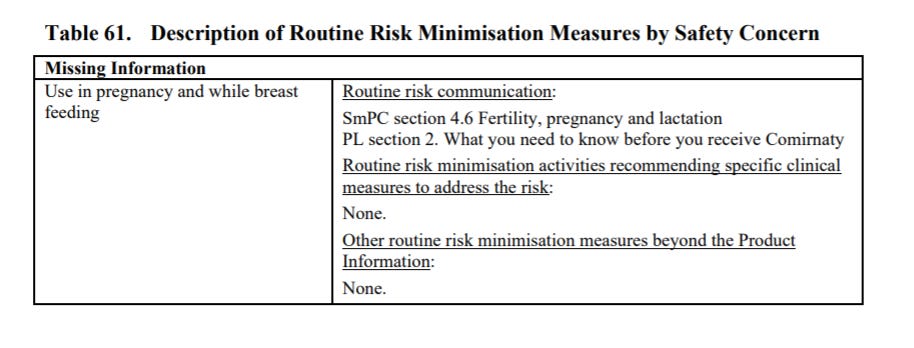
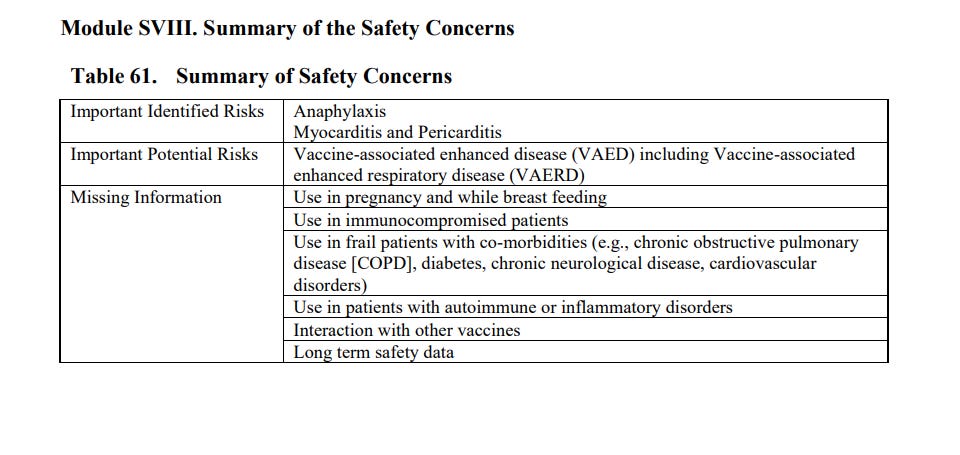
Podsumowując w dokumencie problemy związane z bezpieczeństwem szczepień na str. 119, w tabeli 61 widzimy, że producent zwraca uwagę na fakt, że nie ma informacji o bezpieczeństwie związanym ze stosowaniem preparatu u kobiet w ciąży i karmiących:
W tabeli 64 na str. 154 jest opis rutynowych środków minimalizacji ryzyka według zagrożeń dla bezpieczeństwa ale w części zalecającej konkretne środki kliniczne mające na celu eliminację ryzyka jest brak takowych:
Str. 154, tabela 66 podsumowująca działania w zakresie nadzoru nad bezpieczeństwem farmakoterapii i działania w zakresie minimalizacji ryzyka pokazuje zbiorczo trwające i planowane badania dotyczące kobiet w ciąży i karmiących - brak jest jakichkolwiek badań zakończonych - bo jak pamiętamy ta kohorta była wykluczona z badań klinicznych.
Niezwykle ciekawą lekturą jest inny dokument Pfizera pod nazwą “Badanie fazy 1/2/3 oceniające bezpieczeństwo, tolerancję, immunogenność i skuteczność szczepionek RNA przeciwko COVID-19 u zdrowych osób” opublikowane w listopadzie 2020: https://cdn.pfizer.com/pfizercom/2020-11/C4591001_Clinical_Protocol_Nov2020.pdf .
Na stronie 67 w części 8.3.5 Kontakt z uczestnikami badania w czasie ciąży lub karmienia piersią oraz narażenie w miejscu pracy czytamy, że Pfizer wymagał, żeby każdorazowo zgłaszać takie przypadki w przeciągu 24 godzin od zdarzenia.
Co to jest narażenie podczas ciąży (Exposure During Pregnancy - EPD)? Występuje wtedy, kiedy:
stwierdzono, że uczestniczka jest w ciąży podczas trwania lub po przerwaniu uczestnictwo w badaniu
stwierdzono, że kobieta jest w ciąży, gdy jest lub była narażona na oddziaływanie badania z powodu narażenia środowiskowego (czyli np. jeśli ktoś z rodziny lub pracownik medyczny zgłosi, że ciężarna mogła być narażona na kontakt z preparatem przez wdychanie lub kontakt przez dotyk, ale też wtedy, kiedy kobieta ma kontakt z kimś zaszczepionym w czasie lub tuż przed zapłodnieniem)
W takich przypadkach prowadzący badanie będzie śledził ciążę do jej zakończenia (lub do jej przerwania) i powiadamia firmę Pfizer Safety. Nieprawidłowe wyniki ciąży są uznawane za SAE (Serious Adverse Events - ciężkie NOPy). Jeśli wynik ciąży spełnia kryteria SAE (tj. ciąża pozamaciczna, poronienie samoistne, wewnątrzmaciczny zgon płodu, zgon noworodka lub wada wrodzona), badacz powinien postępować zgodnie z procedurami dla zgłaszania SAE. Punkt 8.3.5.2. dotyczy narażenia podczas karmienia piersią.
W tym dokumencie w punkcie 5.2 na str. 41-42 Pfizer szczegółowo podaje kryteria wykluczenia z badań klinicznych - pozycja 11 to kobiety w ciąży lub karmiące piersią.
Jakie podstawy naukowe mają te osoby, które twierdzą, że szczepienia na Covid-19 są bezpieczne dla kobiet w ciąży i karmiących?
W dalszej części dokumentu - w załączniku nr 4 podane są szczegółowe zalecenia antykoncepcyjne dla kandydatów do badań klinicznych - zarówno mężczyzn jak i kobiet. Do udziału w badaniu kwalifikują się mężczyźni, którzy w okresie badania i przez co najmniej 28 dni po przyjęciu ostatniej dawki, co odpowiada czasowi potrzebnemu do wyeliminowania ryzyka dla bezpieczeństwa reprodukcyjnego związanego z badaną interwencją (badanymi interwencjami), zgodzą się na spełnienie następujących wymagań: powstrzymają się od oddawania spermy i/albo zachowają abstynencję od stosunków heteroseksualnych z kobietą w wieku rozrodczym jako preferowanego i zwyczajowego stylu życia (abstynencja długotrwała i stała) oraz wyrażą zgodę na zachowanie abstynencji, lub zdecydują się na korzystanie z prezerwatyw podczas stosunku.
Wymagania dotyczące kobiet są bardziej szczegółowe i opisane na stronach 132 -135.
Czytając te dokumenty wypada zadać pytanie, na jakiej podstawie producent szczepionki podaje w ulotce (dostępna tu https://www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information_pl.pdf ) na stronach 88, 100 i 110 pisze: “ Ciąża i karmienie piersią - Jeśli pacjentka jest w ciąży, należy powiedzieć o tym lekarzowi, pielęgniarce lub farmaceucie przed otrzymaniem tej szczepionki. Szczepionka Comirnaty może być stosowana w okresie ciąży. Informacje uzyskane od dużej liczby kobiet zaszczepionych w drugim i trzecim trymestrze ciąży szczepionką Comirnaty nie wykazały niekorzystnego wpływu na ciążę lub noworodka. Informacje dotyczące wpływu na ciążę lub noworodka po zaszczepieniu w pierwszym trymestrze są obecnie ograniczone, jednakże nie stwierdzono zmiany ryzyka poronienia. Szczepionka Comirnaty może być podawana podczas karmienia piersią”???