VAERS - co pokazują dane
VAERS jest narzędziem nadzoru nad bezpieczeństwem farmakoterapii FDA w CDC i służy do wykrywania zdarzeń niepożądanych, które nie zostały rozpoznane w badaniach przed wprowadzeniem produktu na rynek
"Panie Mariuszu - jak można Pana wesprzeć?" - zadał mi pytanie jeden z moich subskrybentów. Blog na Substacku jest to hobby czasochłonne, ale nie planowałem tej działalności, jako źródła dodatkowego dochodu (do tej pory mam jednego płatnego subskrybenta ochotnika). Ale jeśli ktokolwiek uważa, że warto udzielić mi wsparcie finansowe - to poniższa zrzutka daje taką możliwość. Za każdą wpłatę - serdecznie dziękuję :)
W dniach 2-4 maja 2023 odbył się w Parlamencie Europejskim trzeci już Międzynarodowy Szczyt COVID. Gospodarzami szczytu byli nieustający w dążeniu do ujawnienia prawdy parlamentarzyści – Christine Anderson, Francesca Donato, Cristian Terhes, Ivan Vilibor Sincic i Mislav Kolakusic. Wśród zaproszonych gości można znaleźć takie nazwiska jak Robert Malone, Byram Bridle, Pierre Kory, Christian Perrone, Didier Raoult, Jessica Rose i wielu innych.
Jessica Rose, ekspertka w dziedzinie matematyki stosowanej, immunologii, biologii obliczeniowej, biologii molekularnej i biochemii w swoim wystąpieniu skupiła się na analizie amerykańskiej bazy VAERS. Utworzony w 1990 roku system zgłaszania niepożądanych zdarzeń poszczepiennych (Vaccine Adverse Event Reporting System, VAERS) jest krajowym systemem wczesnego ostrzegania służącym do wykrywania ewentualnych problemów związanych z bezpieczeństwem stosowania szczepionek dopuszczonych do obrotu w Stanach Zjednoczonych, innymi słowy jest narzędziem nadzoru nad bezpieczeństwem farmakoterapii i służy do wykrywania zdarzeń niepożądanych, które nie zostały rozpoznane w badaniach klinicznych przed wprowadzeniem produktu na rynek. System VAERS jest zarządzany wspólnie przez Centra Kontroli i Prewencji Chorób (CDC) oraz Amerykańską Agencję ds. Żywności i Leków (FDA). VAERS przyjmuje i analizuje zgłoszenia zdarzeń niepożądanych (możliwych skutków ubocznych) po otrzymaniu przez daną osobę szczepionki. Każdy może zgłosić zdarzenie niepożądane do VAERS ale pracownicy służby zdrowia są zobowiązani do zgłaszania określonych zdarzeń niepożądanych, a producenci szczepionek są zobowiązani do zgłaszania wszystkich zdarzeń niepożądanych, o których się dowiedzieli. VAERS to jeden z wielu systemów rejestrowania NOPów, w Wielkiej Brytanii jest Yellow Card, WHO prowadzi VigiAccess, a Unia Europejska ma EudraVigilance, przewagą VAERS jest łatwy dostęp do danych, które każdy może pobrać do analizy. Dane VAERS są dostępne poprzez pobranie surowych danych w plikach z wartościami oddzielonymi przecinkami (CSV) w celu zaimportowania ich do bazy danych, arkusza kalkulacyjnego lub programu do edycji tekstu, albo za pomocą internetowego narzędzia wyszukiwania CDC WONDER. „Surowe” dane zamieszczane w systemie VAERS są mało czytelne wiec powstają strony przyjazne dla użytkownika jak wyszukiwarka https://www.medalerts.org/vaersdb/index.php czy https://openvaers.com/ lub https://vaersanalysis.info/, które w przejrzysty sposób obrazują zgromadzone w systemie informacje.
VAERS jest pasywnym systemem raportowania, co oznacza, że każdy, w tym osoby prywatne mogą wysyłać raporty o swoich doświadczeniach do CDC i FDA. VAERS nie jest przeznaczony do ustalania, czy szczepionka spowodowała problem zdrowotny, ale jest szczególnie przydatny do wykrywania niezwykłych lub nieoczekiwanych wzorców zgłaszania zdarzeń niepożądanych, które mogą wskazywać na potencjalny problem bezpieczeństwa szczepionki. W ten sposób VAERS może dostarczyć CDC i FDA cennych informacji, że konieczna jest dodatkowa praca i ocena potencjalnego problemu bezpieczeństwa. Mocną stroną VAERS jest to, że ma on zasięg krajowy i może potencjalnie szybko wysłać sygnał z ostrzeżeniem o problemie bezpieczeństwa szczepionki. VAERS zaprojektowano w celu szybkiego wykrywania nietypowych lub nieoczekiwanych wzorców zdarzeń niepożądanych, znanych właśnie jako "sygnały bezpieczeństwa". Jeśli taki sygnał zostanie znaleziony, można przeprowadzić dalsze badania w innych systemach bezpieczeństwa, takich jak CDC's Vaccine Safety Datalink (VSD) lub projekt Clinical Immunization Safety Assessment (CISA).
System VAERS, niewątpliwie bardzo przydatny i potrzebny, jest jednak niedoskonały - poważnym problemem jest niedostateczna liczba zgłoszeń, a także niedostateczne rejestrowanie. Eksperci medyczni z Departamentu Zdrowia i Usług Społecznych zdają sobie także sprawę z innych ograniczeń VAERS jak zgłaszanie niewiarygodnych informacji ale szybko usuwają wyraźnie fałszywe zgłoszenia. Koronnym przykładem rzekomo małej wiarygodności bazy VAERS podawanym przez krytyków jest znany przypadek, kiedy anestezjolog James Laidler użył systemu do zgłoszenia, że szczepionka zmieniła go w "Incredible Hulk” a system to przyjął. Zgłoszenie zostało usunięte, ale jak twierdzi Laidler, dopiero kiedy udzielił na to zgody. Obecnie na stronie do zgłaszania zdarzeń niepożądanych widnieje informacja o odpowiedzialności karnej za składanie fałszywych danych: „Świadome złożenie fałszywego raportu VAERS stanowi naruszenie prawa federalnego (18 U.S. Code § 1001), które podlega karze grzywny i pozbawienia wolności.” Mimo swych wad system działa: „VAERS spełnia swoją rolę - pod warunkiem, że dane tam umieszczane są analizowane” – twierdzi Jessica Rose - „Problem polega na tym, że Ci, do których dane należą, czyli HHS, FDA i CDC, nie robią tego, co zwykli robić w przeszłości, jak np. kiedy szczepionka przeciw rotawirusom w 1999 r. została wycofana z rynku, gdy zgłoszono kilka przypadków wgłobienia jelita”.
Czym są zdarzenia niepożądane? To każdy nieoczekiwany incydent, które wystąpił w bezpośredniej bliskości czasowej podania produktu biologicznego. Mogą to być zarówno łagodne zdarzenia niepożądane, takie jak ból w miejscu wstrzyknięcia lub ból głowy, jak i ciężkie zdarzenia niepożądane, w tym zgony. W Polsce NOP – Niepożądany Odczyn Poszczepienny to z definicji każde zdarzenie (zaburzenie stanu zdrowia, nadmierna reakcja organizmu), którego wystąpienie nie było celem podania szczepionki, a które występujące w ciągu 28 dni od podania szczepionki. W związku z czym, jeżeli w ciągu tych 4 tygodni, osoba która była zaszczepiona, dostanie na przykład zawału, udaru, umrze, spuchnie, czy będzie jej duszno, to zgodnie z definicja, jest to NOP, który powinien być zgłoszony, zaś lekarz nie powinien analizować związków przyczynowo-skutkowych a jedynie czasowe. Dzieje się tak dlatego, że w przypadku nowych preparatów nikt do końca nie wie jakie niepożądane zdarzenia mogą wystąpić. Mogą to być zaburzenia w obrębie układu krzepnięcia, zaburzenia w układzie odpornościowym typu anafilaksja, zaburzenia neurologiczne.
Projektując nowy produkt biologiczny jakiegokolwiek rodzaju należy zwrócić uwagę na dwie podstawowe kwestie - bezpieczeństwo i skuteczność. System VAERS wskazuje na kwestie związane z bezpieczeństwem, ale także pomaga wyciągnąć wnioski o związku przyczynowym, co często jest przedmiotem bardzo gorącej debaty oraz o skuteczności, jeśli analizuje się go łącznie z innymi dostępnymi danymi. Jessica Rose dowodzi, że baza VAERS może także pokazywać związek przyczynowy, a nie wyłącznie czasowy: “sposobem, w jaki epidemiolog lub biolog może przedstawić dowody na istnienie związku przyczynowego na podstawie danych biologicznych, jest zastosowanie czegoś, co nazywa się Kryteriami Bradforda Hilla, jest to zestaw 10 punktów, które powinny być spełnione, aby uzyskać dowód na istnienie związku przyczynowego, przy czym nie trzeba spełniać wszystkich dziesięciu kryteriów – już 8 to bardzo silny dowód potwierdzający taki związek”.
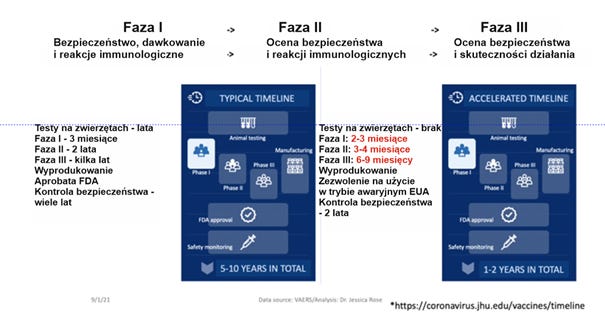
Wracając do kwestii bezpieczeństwa i skuteczności – czas potrzebny na opracowywania szczepionki to zwykle od 5 do 10 lat, czasem nawet dłużej. Jest to konieczne, aby właściwie ocenić bezpieczeństwo i skuteczność danego leku biologicznego w warunkach badań klinicznych, potrzebny jest także czas na zatwierdzenie leku przez organy regulacyjne, trzeba wyprodukować odpowiednią ilość produktu, aby móc go potem dystrybuować. Istotna jest tu definicja bezpieczeństwa i skuteczności, a także zrozumienie pojęcia ryzyka. Ryzyko jest miarą prawdopodobieństwa wystąpienia zdarzenia niepożądanego lub jakiegoś niepożądanego wyniku oraz wagi wynikającej z tego szkody dla zdrowia jednostki w populacji. Bezpieczeństwo jest zatem oceną dopuszczalności tego ryzyka w określonej sytuacji, np. przy wprowadzaniu na rynek nowego produktu biologicznego. Skuteczność to prawdopodobieństwo odniesienia korzyści przez osoby w określonej populacji dzięki technologii medycznej zastosowanej w odniesieniu do danego problemu medycznego, w tym pojawienia się patogenu, np. wirusa SARS.
Typowy czas od badań na zwierzętach do monitorowania bezpieczeństwa wynosi około 5-10 lat. Badania na zwierzętach mogą trwać lata, czasem tylko miesiące - zależy to od tego, jak rozwijają się dane laboratoryjne. Badania kliniczne pierwszej fazy, w których bierze udział niewielka liczba osób, trwają zazwyczaj kilka miesięcy, a po ich zakończeniu przechodzi się do badań drugiej fazy, w których bierze udział większa liczba osób. Jeśli badania II fazy przebiegną prawidłowo i nie wystąpi zbyt wiele zdarzeń niepożądanych, można przejść do badań III fazy, w których bierze udział znacznie większa grupa osób. Trwa to zwykle kilka lat. Po zakończeniu badań III fazy, jeśli zakończą się one sukcesem, przechodzi się do procesu produkcji i zatwierdzania, a te dwa etapy są ze sobą ściśle powiązane. Następnie produkty są monitorowane przez wiele lat za pomocą narzędzi nadzoru nad bezpieczeństwem farmakoterapii, właśnie takich jak VAERS. W przypadku produktów nowatorskiej technologii mRNA mieliśmy do czynienia z tak zwaną przyspieszoną linią czasu. Jest to nowa koncepcja, a stworzono ją, ponieważ w marcu 2020 WHO ogłosiła, że świat stoi w obliczu kryzysu i ogłoszono globalną pandemię. Łączny czas trwania badania III fazy prowadzonego przez konsorcjum Pfizer/BioNTech wynosił sześć miesięcy (!). Nie były przeprowadzane badania na zwierzętach przed badaniami fazy I, badania fazy II i I były zmieszane. Badania fazy II trwały tylko trzy miesiące, co jest możliwe, ale niedopuszczalne jest mieszanie faz badania. Nie bez powodu są one uporządkowane sekwencyjnie. Zatem łączny czas trwania badania III fazy firmy Pfizer BioNTech wyniósł sześć miesięcy...
Pani Rose twierdzi, że sygnał bezpieczeństwa w VAERS był bardziej niż wystarczająco widoczny już w styczniu 2021 roku, kiedy odnotowano we wszystkich grupach wiekowych, nawet w przedziale od 0 do 4 lat, prawie 700 zgonów. Do tej pory po przekroczeniu pewnej liczby zgonów (zwykle 50) w kontekście leku profilaktycznego lub szczepionki reagowano natychmiastowo wycofując produkt z rynku.
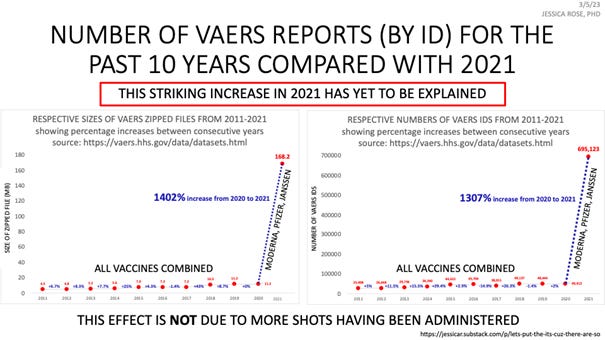
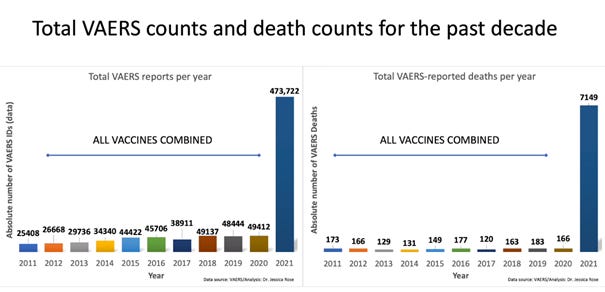
VAERS działa od 30 lat, dane z ostatnich 10 lat są na porównywalnym poziomie zarówno dla wielkość pliku, jak i liczby zgłoszeń niepożądanych. W roku 2021 wielkość pliku danych wzrosła o 1400% zaś wzrost liczby zgłoszeń o zdarzeniach niepożądanych wynosi 1300%. I nikt z przedstawicieli agend rządowych tego nie widzi i nie stara się tego wytłumaczyć! Wiele osób twierdzi, że ten niewytłumaczalny wzrost związany jest z faktem, że obecnie podaje się więcej szczepionek, ale przeprowadzone badanie porównujące liczbę szczepień Covid-19 z liczbą szczepień przeciwko grypie dowodzi, że tak nie jest. Ten sam sygnał bezpieczeństwa można zaobserwować, jeśli wybierzemy dowolny pojedynczy rodzaj zdarzenia niepożądanego np. ze strony układu sercowo-naczyniowego, neurologicznego i immunologicznego. Wzrosła liczba zgłoszeń dotyczących chorób układu rozrodczego u kobiet, od samoistnych poronień po zaburzenia miesiączkowania. Liczba zgonów jest najwyższa od 30 lat, porównując C-19 i wszystkie inne szczepionki. Średnia liczba zgonów historycznie wynosiła około 150 rocznie w ciągu ostatnich dziesięciu lat i dotyczy to wszystkich szczepionek łącznie. W roku 2021 odnotowano 7149 zgonów (stan na wrzesień 2021):
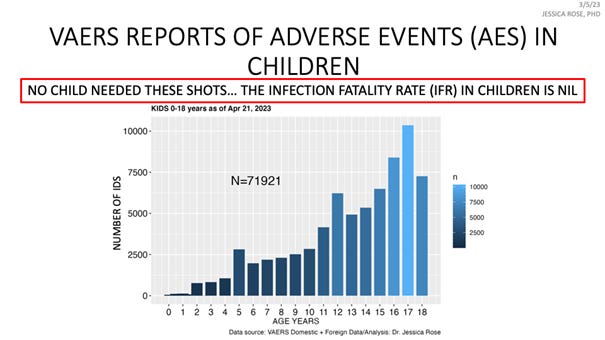
Każde badanie kliniczne I, II i III fazy ma listę kryteriów wykluczenia, a listy te są zazwyczaj bardzo długie. Zawsze znajdują się na nich kobiety w ciąży, kobiety karmiące lub kobiety w wieku rozrodczym, ze względu na potencjalne ryzyko. Badanie kliniczne szczepionek mRNA także uwzględniało na liście kryteriów wykluczenia kobiety w ciąży, kobiety karmiące, osoby z obniżoną odpornością oraz osoby z chorobami autoimmunologicznymi, co oznacza, że nie mogły one uczestniczyć w tych sześciomiesięcznych badaniach. Jak to więc możliwe, że zdecydowano się wstrzykiwać te preparaty kobietom w ciąży bez żadnych danych dotyczących bezpieczeństwa? Wiedzieliśmy, że szczepienia nie są niepotrzebne u dzieci, COVID nie jest dla nich niebezpieczną chorobą - wskaźnik śmiertelności po zakażeniu u dzieci jest zerowy, jednak kładziono nacisk na to, aby szczepić nawet bardzo małe dzieci, niemowlęta - nasuwa się pytanie: dlaczego? Ani jedno dziecko nie powinno umrzeć w kontekście leczenia profilaktycznego, w którym nie ma ryzyka śmierci z powodu choroby!
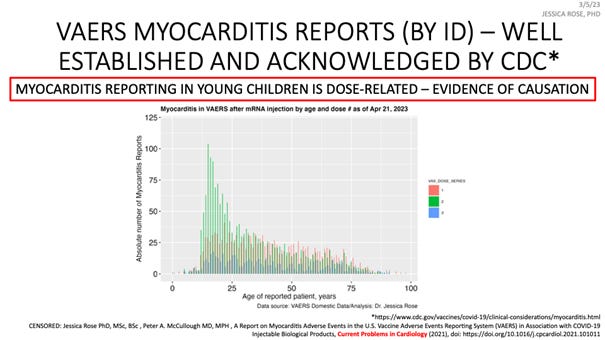
Jessica Rose kończąc prezentację slajdem dotyczącym zapalenia mięśnia sercowego, który jest problemem uznanym nawet przez CDC, mówi: „po dawce 2 następuje znacznie większy wzrost lub znacznie wyższy wskaźnik zgłoszeń dla drugiej dawki. To wskazuje, że istnieje dowód na istnienie związku przyczynowego i chcę tylko powiedzieć, że ilekroć słyszę ludzi powtarzających jak mantrę, że korelacja nie oznacz związku przyczynowego, zastanawiam się, czy kiedykolwiek słyszeli o kryteriach Bradforda Hilla, ponieważ są to kryteria, których można użyć, aby dostarczyć bardzo solidny dowód na istnienie związku przyczynowego i danych epidemiologicznych, a ja spełniłam wszystkie 10 kryteriów”.
Źródła:
https://www.internationalcovidsummit.com/
https://rumble.com/vmprzh-jessica-rose-phd-adverse-events-reporting-what-do-the-data-tell-us.html
To jak lekarz powinien zgłaszać NOP reguluje rozporządzenie Ministerstwa Zdrowia z 2010 https://isap.sejm.gov.pl/isap.nsf/download.xsp/WDU20102541711/O/D20101711.pdf (zmienione w 2020 - https://sip.lex.pl/akty-prawne/dzu-dziennik-ustaw/zmiana-rozporzadzenia-w-sprawie-niepozadanych-odczynow-poszczepiennych-19067438 )
https://medalerts.org/vaersdb/index.php
https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process